
Анодное растворение сплава вольфрам–цирконий в щелочном электролите
ISSN 1812-3368. Вестник МГТУ им. Н.Э. Баумана. Сер. Естественные науки. 2017. № 2
99
Значения стационарных потенциалов
ст
в электролите 15 % NaOH + 5 % NaF
для сплава W–Zr с различным содержанием циркония
Содержание циркония в образце, % … 18,0 2,0
1,6
0,9
ст
,
мВ ………………………………… –705 –690 – 675 –640
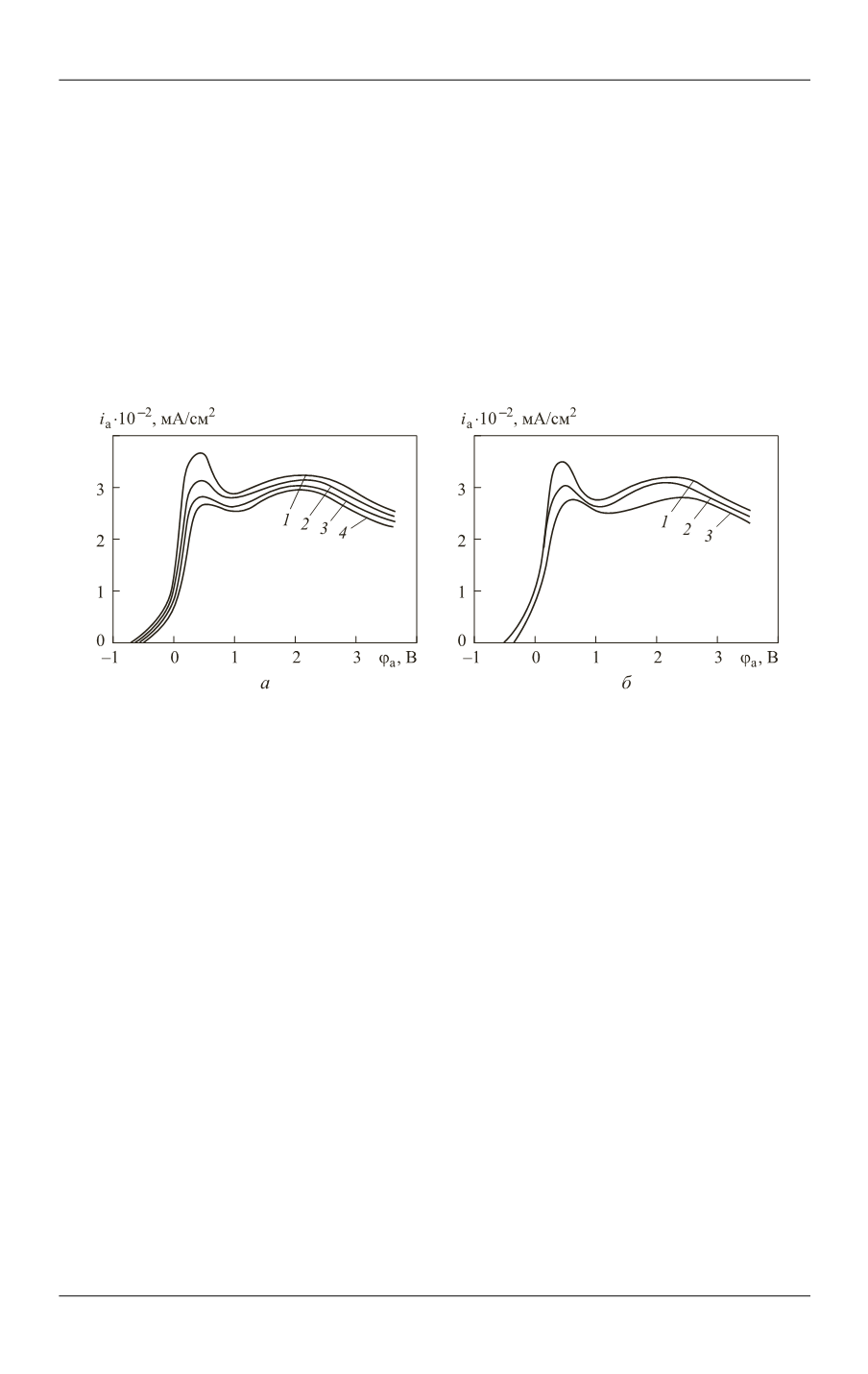
Анодные кривые, полученные в электролите указанного состава, показаны
на рис. 2,
а
. Увеличение содержания циркония в сплаве активирует процесс
электрохимического растворения, возрастают значения плотности анодного
тока. Отдельно выраженные максимумы анодного растворения циркония в об-
ласти потенциалов, предшествующих пассивации, на кривых не отмечены.
Рис. 2.
Анодные поляризационные кривые образцов сплава W–Zr:
а
— электролит 15 % NaOH + 5 % NaF (
1
— Zr (18 %);
2
— Zr (2 %);
3
— Zr (1,6 %);
4
— Zr (0,9 %));
б —
щелочной электролит (
1
— 15 % NaOH +5 % NaF;
2
— 15 % NaOH + Na
2
C
4
H
4
О
6
;
3
— 15 % NaOH)
В настоящей работе было изучено влияние состава электролита на характер
анодного растворения сплава W–Zr (18 %). В качестве возможных активирующих
добавок к основному электролиту применялись соли органической и неорганиче-
ской природы, выбор которых основывался на окислительных и комплексообра-
зующих свойствах анионов по отношению к компонентам сплава [9–15].
Приведенные в таблице значения стационарных потенциалов
ст
для спла-
ва W–Zr (18 %), измеренные в электролитах с разными анионными добавками,
показывают различие их активирующих воздействий уже при отсутствии поля-
ризации. Экспериментальные значения потенциалов окислительно-восстано-
вительных систем вольфрама и его сплавов, приводимые в различных литера-
турных источниках, различаются [16]. Это можно объяснить изначально раз-
ным состоянием поверхностного слоя образца и неполной воспроизводимостью
поверхности при подготовке к измерениям [17, 18].
Анодные кривые, полученные в электролитах (
1–3
), приведены на рис. 2,
б
.
Общими для кривых являются участки растворения, пассивные участки и площад-
ки предельного тока. В начале поляризации, при достаточно низких значениях
















