
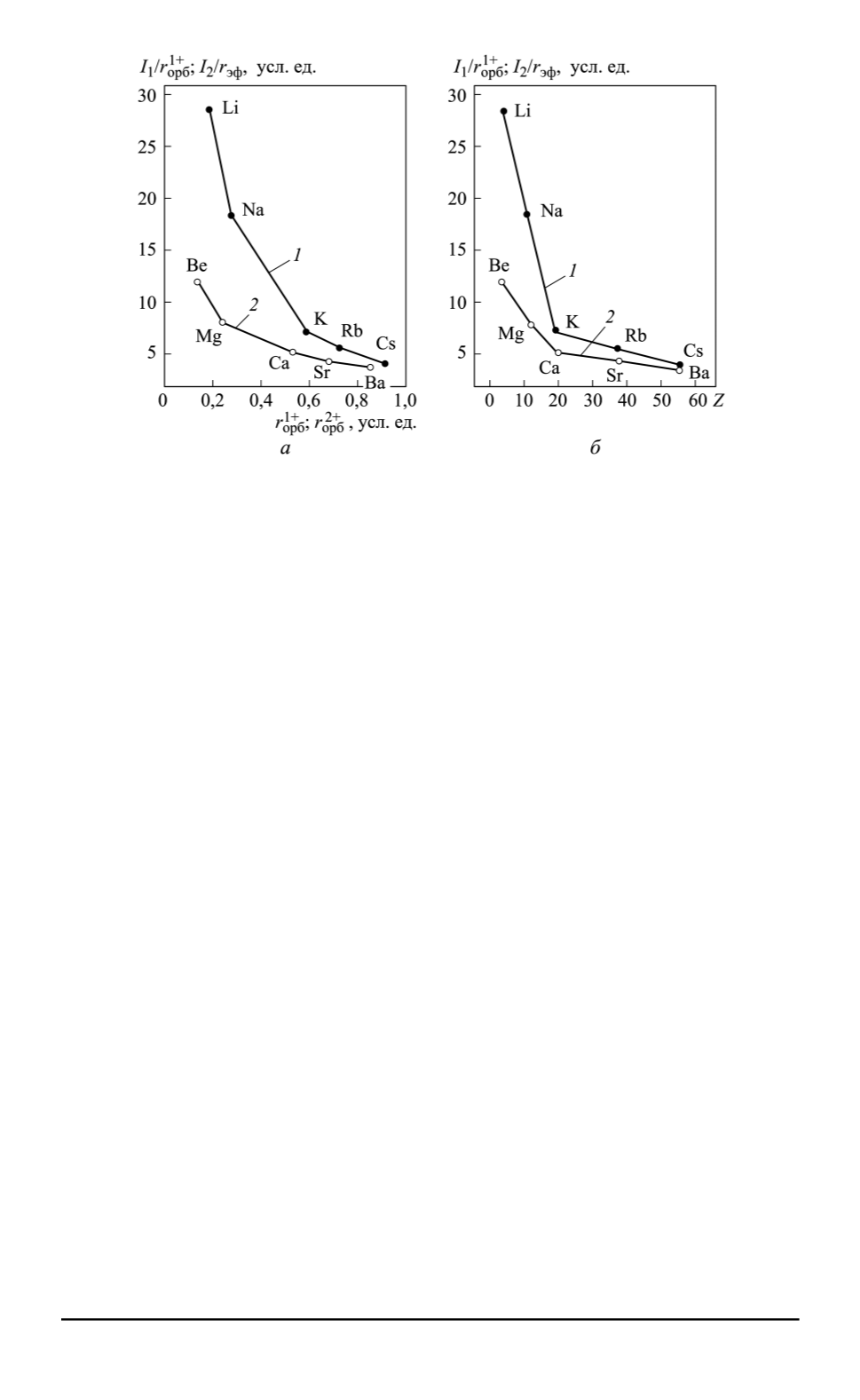
Рис. 5. Зависимости
I
1
/
r
1+
орб
и
I
2
/
r
эф
для элементов первой (
1
) и второй (
2
)
групп от орбитальных радиусов
r
1+
орб
и
r
2+
орб
(
а
) и атомного номера
Z
(
б
)
(рис. 5) также обнаруживается практическое совпадение силовых ха-
рактеристик для бария и цезия, как ближайших аналогов в Периоди-
ческой таблице.
Сходство химических свойств бария и радия со свойствами щелоч-
ных металлов и отличие от легких шелл-аналогов отражается в струк-
турных особенностях их кристаллов. Плотнейшая упаковка металли-
ческих фаз легких элементов второй группы (Ве–Sr) при атмосфер-
ном давлении и комнатной температуре переходит в “разрыхленную”
упаковку (ОЦК) у бария и радия, которая характерна для типичных
металлов первой группы.
В заключение следует отметить, что в рассмотренных подходах
к объяснению кристаллического строения веществ, в том числе эле-
ментов второй группы, учитывалось влияние лишь одного фактора —
строения энергетических уровней атомов.
Многочисленные примеры и, в частности, явление полиморфизма,
подтверждают вывод о том, что кристаллическое строение вещества
есть функция не только строения энергетических уровней атомов и
характера их заселения электронами. Не вызывает сомнения, что она
также является функцией внешних параметров и, следовательно, весь-
ма чувствительна к их изменению. При этом строение энергетических
уровней атомов — имманентное свойство вещества, обусловленное ис-
ключительно его природой и не зависящее от внешних воздействий.
Влияние внешних факторов отражается лишь на распределении элек-
тронов по квазинепрерывным допустимым квантовым состояниям в
твердой фазе. Поэтому для достоверной оценки характера распределе-
ISSN 1812-3368. Вестник МГТУ им. Н.Э. Баумана. Сер. “Естественные науки”. 2015. № 5
123
















